2025年10月24日
理化学研究所
東京大学
早稲田大学
世代を超えてテロメアDNAを維持する新たな仕組み
-線虫テロメレースRNAによる「イントロン・ヒッチハイク」-
理化学研究所(理研)生命機能科学研究センター 配偶子形成研究チームの澁谷 大輝 チームディレクター、竹田 穣 基礎科学特別研究員、石田 森衛 研究員、梶川 絵理子 テクニカルスタッフⅠ、発生ゲノムシステム研究チームの近藤 武史 チームディレクター、生命医科学研究センター 高機能生体分子開発チームの田上 俊輔 チームディレクター、東京大学 定量生命科学研究所の齊藤 博英 教授、早稲田大学 理工学術院の浜田 道昭 教授らの国際共同研究グループは、線虫[1]のテロメレース[2]RNAが遺伝子のイントロン[3]中に存在することを発見し、生殖細胞でテロメア[2]が次世代に向けて伸長される新しいメカニズムを解明しました。
本研究成果は、世代をまたいでDNAを継承する生物生存戦略の新たな分子メカニズムを提案し、生命進化の理解に貢献するものです。
真核生物のDNA末端にあるテロメアは細胞分裂のたびに短縮するため、やがて細胞は染色体を維持できなくなり寿命を迎えます。しかし、次世代へと引き継がれる唯一の細胞系譜である生殖細胞では、テロメアが伸長されて次世代に伝達され、世代を経てもテロメアが短縮することなく、種の存続が担保されます。
今回、国際共同研究グループは、テロメアを伸長する酵素の活性化に必須なテロメレースRNAを線虫で同定したところ、既知の生物種の中で唯一、線虫のテロメレースRNAだけが、タンパク質をコードする遺伝子のイントロンに存在する特殊なRNAであることを発見しました。生殖細胞で発現する遺伝子のイントロンにテロメレースRNAが「ヒッチハイク」することで、次世代に向けた生殖細胞特異的なテロメアの伸長を行い、種の存続を保証するという巧妙な仕組みが明らかになりました。
本研究は、科学雑誌『Science』オンライン版(10月23日付:日本時間10月24日)に掲載されました。
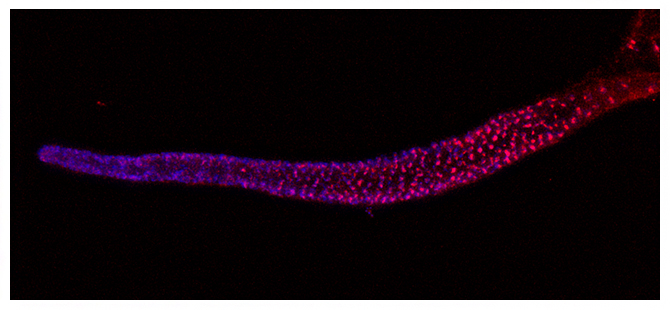
イントロン・ヒッチハイクにより線虫の生殖細胞(青)で発現するテロメレースRNA(赤)
背景
真核生物の染色体は線状のDNAで構成されています。細胞が分裂するとき、染色体DNAはDNA合成酵素の働きにより複製されますが、酵素反応の仕組み上、染色体末端のDNA(テロメア)には複製できない領域が残されます。従ってテロメアは細胞分裂のたびに短縮され、これにより、体をつくる細胞の寿命(分裂回数の上限)が規定されます。一方、次世代へと引き継がれる唯一の細胞系譜である生殖細胞では、テロメアが十分に伸長されて次世代に伝達されることで、種の存続が担保されています(図1左)。もしテロメアが生殖細胞で伸長されなければ、テロメアは世代を経るごとに徐々に短縮され、最終的に種は絶滅に至ります。
テロメアの伸長には、細胞分裂の際に働くDNA合成酵素とは異なる「テロメレース」と呼ばれる酵素が必要なことが知られています。テロメレースは、タンパク質とRNAから成るホロ酵素[4]として機能し、RNAを鋳型として逆転写反応[5]によりDNAを合成し、テロメアを伸長させます(図1右)。例えば、半永続的に増殖する多くのがん細胞では、このテロメレースが異常に活性化することでテロメアが維持され、分裂限界を超えて半永続的に増殖できます。一方、健康な生体内では、例外的に幹細胞と生殖細胞のテロメレースが活性化されています。特に生殖細胞では、その特別に長いテロメアを維持するために、体性幹細胞にも増してテロメレースの活性が高いことが知られています。転写制御など一部の調節機構は明らかになってきているものの、テロメレースの組織特異的な活性化メカニズムの全体像はまだ十分には解明されていません。
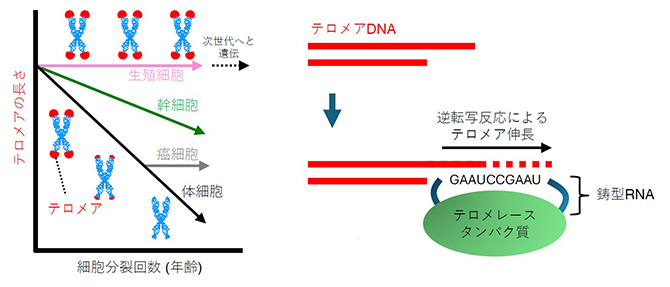
図1 テロメアの長さの制御
- 左:テロメアは細胞分裂のたびに短縮するが、がん化した細胞や体性幹細胞ではテロメレースが活性化することで、比較的長いテロメアが維持される。生殖細胞は中でも特殊で、次世代へとテロメアを伝達するために、非常に長いテロメアが維持されるが、そのメカニズムの多くは未解明である。
- 右:テロメレースは逆転写酵素であるタンパク質と鋳型RNAから構成される。逆転写反応により、RNAを鋳型としてテロメアDNAを合成する。
澁谷チームディレクターは、生殖細胞におけるテロメレース活性やテロメアが世代を超えて維持される仕組みを調べるため、世代時間が3日と短い線虫(Caenorhabditis elegans、以下C. elegans)を用いて研究してきました。C. elegansのテロメレースの構成分子のうち、テロメレースタンパク質TRT-1は、ヒトのテロメレースタンパク質との相同性から、2006年に同定されています。しかし、その酵素活性に必須な相方となるテロメレースRNAは、先行研究における試行錯誤にもかかわらず、C. elegansやその他の線形動物門に属する線虫類いずれにおいても発見されていませんでした(図2)。これは線虫類のテロメレースRNAが他の動物のものとは全く異なる配列や構造を有する可能性や、あるいは特殊なゲノム上の位置に存在することで、通常の遺伝子予測では発見が難しい特殊なRNAであることに起因すると推測されていましたが、詳細は明らかになっていませんでした。
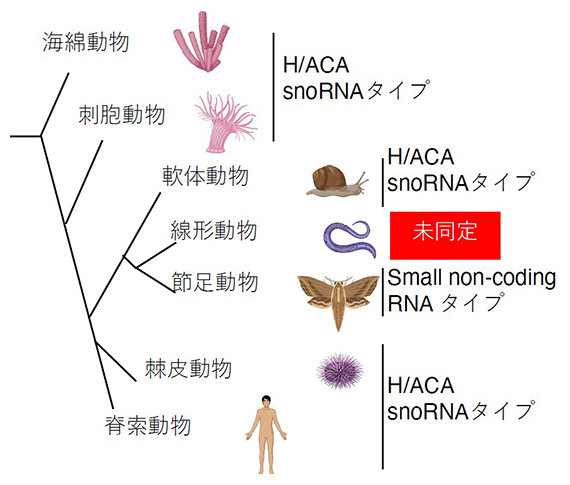
図2 後生動物のテロメレースRNA
海綿動物からヒトに至る多くの後生動物でテロメレースRNAが同定されている。これらは全て独自のプロモーターから転写されるnon-coding RNA遺伝子としてコードされており、H/ACAタイプの核小体低分子RNA(snoRNA)に似た配列を持つ。線虫を含む線形動物門では、いまだにテロメレースRNAは未同定であった。なお昆虫類では例外的に、H/ACAタイプとは異なる核内低分子RNA(snRNA)タイプのテロメレースRNAを持つもの(ハチ目)、small non-coding RNAタイプを持つもの(鱗翅目(りんしもく))、トランスポゾン転移型のテロメアを持つもの(ショウジョウバエ)がいる。
研究手法と成果
テロメレースの発現量は多くの生物において、テロメアの異常な伸長を防ぐために必要最小限に抑えられていることが知られています。この絶対量の少なさが生体内でテロメレースを研究する上での大きな障壁の一つになっています。国際共同研究グループは、C. elegansのテロメレースRNAを同定するために、まず遺伝子改変した線虫個体からテロメレースタンパク質TRT-1を大量につくらせて、精製し、そこに結合するRNAをeCLIP法[6]により回収するスクリーニング手法を考案しました。その結果見つかったRNAは、予想外なことにモータータンパク質[7]をコードする遺伝子nmy-2[7]のイントロン領域の配列であることが分かりました(図3)。国際共同研究グループはこのRNA配列をテロメレースRNAの候補として、「telomerase RNA component-1(terc-1)」と命名しました。
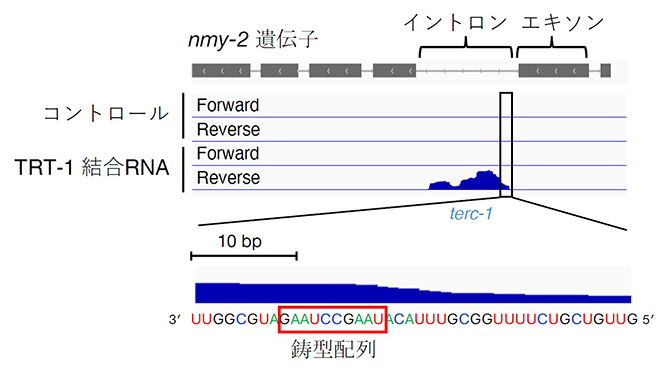
図3 C. elegansテロメレースRNA「terc-1」の発見
テロメレースタンパク質TRT-1に結合するRNAを回収し、その配列を解読した。さまざまな長さのRNAが回収されたが、それらと一致するゲノム配列を検索したところ、モータータンパク質をコードする遺伝子nmy-2のイントロン領域のセンス鎖(タンパク質合成に直接関わる情報を含む鎖)に集中していた。この領域には、C.elegansのテロメアDNA配列に見られる繰り返し配列5'-(TTAGGC)-3'に相補的な「鋳型配列(5'-UAAGCCUAAG-3')」が含まれていた。一方、TRT-1なしにRNAを回収した場合には、nmy-2遺伝子に対応する配列は見いだされなかった(コントロール)。
イントロンは、遺伝子内にあるいわゆる「ジャンク配列[3]」であり、通常は遺伝子が転写された後に切り捨てられて分解されます。イントロンに存在する長鎖非コードRNA[3](intronic long non-coding RNA)がテロメレースRNAを生成する例は、菌や植物を含めた全真核生物でこれまで報告がなく、この実験結果はにわかには信じ難いものでした。しかし、C. elegansに近縁な他の線虫類においても、nmy-2のイントロン領域に類似した配列が確認され、これらは2次構造の面でも高い類似性を示したことから、terc-1が線虫類に保存された配列であることが分かりました。また、①terc-1の配列には、C. elegansテロメアDNAに相補的な「鋳型配列[8]」が含まれていました(図3)。②terc-1配列を欠失させた遺伝子改変線虫は世代を経るごとに徐々に産仔(さんし:出産)の数が減少し、最終的に約15世代以内に死滅しました。③これらの遺伝子改変線虫のテロメアDNAの長さを調べたところ、世代を経るごとに徐々にテロメアが短縮していました(図4)。これらの観察結果などから、terc-1がテロメレースRNAとしての機能を有しており、世代を超えたテロメアの維持や個体群の存続に必須な役割を持つことが証明されました。
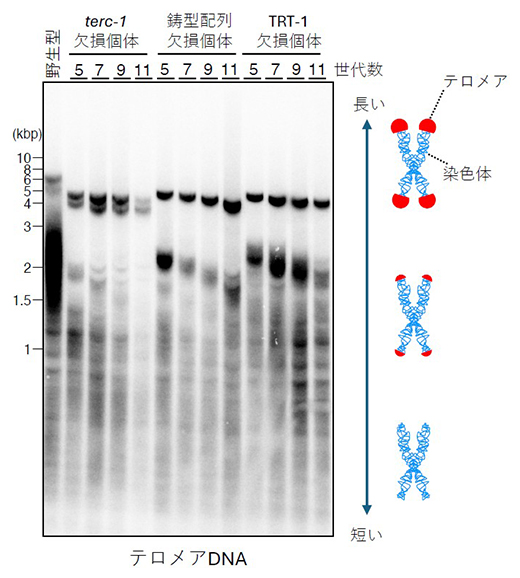
図4 terc-1変異体で見られるテロメアの経世代的な短縮
C. elegansの全細胞からDNAを回収し、テロメアの長さを可視化した電気泳動像。テロメアの長さは細胞によってさまざまだが、野生型C. elegansの泳動像と比較し、terc-1の全長を欠損させた個体や鋳型配列を欠損した個体、およびテロメレースタンパク質TRT-1を欠損させた個体では、テロメアが世代を経るごとに徐々に短縮することが分かる。これらの欠損個体群は、最終的に約15世代で死滅した。kbp(k=1,000、bp=塩基数):核酸の長さを表す単位。
次に国際共同研究グループは、C. elegansの細胞内でterc-1が生成される仕組みを調べました。マウスやヒトの場合は、テロメレースRNAをつくるための専用の遺伝子が存在し、その遺伝子からまず前駆体RNAが転写された後、不要な配列が削られて成熟したテロメレースRNAになります。一方、C. elegansでは、nmy-2遺伝子が転写された後にイントロンが切り離される過程である「スプライシング[9]」がterc-1の発現に必須であり、このスプライシングを阻害するような変異を入れた線虫株ではterc-1が全く発現せず、terc-1欠損個体同様にテロメアの経世代的な短縮が観察されました。さらに、前駆体RNA(スプライシングされたイントロンRNA)から不要な配列を削り「成熟型のテロメレースRNA(terc-1)」を形成する過程はC. elegansにも存在しましたが、この過程を担うタンパク質は哺乳類のものとは異なり、RNA分解酵素に近いものであることが分かりました。
最後に、国際共同研究グループは「なぜterc-1はnmy-2遺伝子のイントロンに存在する必要があるのか」という最大の疑問に答える検証実験を考案しました。そこで、terc-1を本来のnmy-2遺伝子のイントロンから、組織特異的な発現を示す別の遺伝子のイントロンに移植した遺伝子改変C. elegansをゲノム編集技術により作製し、経世代的に観察することでその個体群が存続可能かを検証しました。
その結果、生殖細胞特異的に発現する遺伝子や、生殖細胞を含む全身細胞に発現する遺伝子のイントロンにterc-1を移植した個体群ではテロメアが世代を超えて維持されることが明らかになりました(図5)。またこれらの個体群は実験室で半永久的に継代飼育することが可能でした。それに対して、生殖細胞では発現しない遺伝子(例えば皮下組織、筋組織、神経細胞、咽頭組織特異的な遺伝子)のイントロンにterc-1を移植した個体群は、terc-1欠損個体同様にテロメアの極度な短縮により約15世代以内で絶滅することが明らかになりました(図5)。
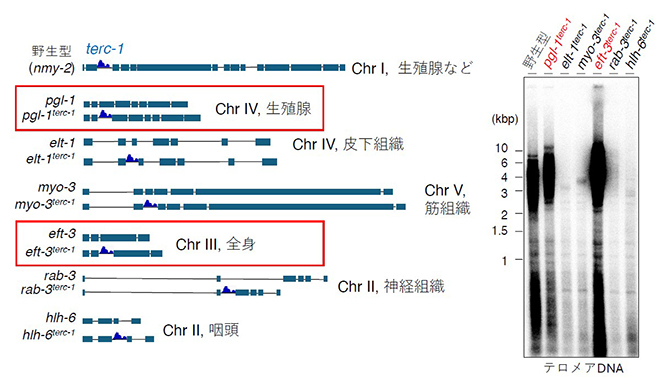
図5 terc-1の移植実験
terc-1をnmy-2遺伝子のイントロンから、組織特異的な発現を示す遺伝子のイントロンへと移植した(左図)。生殖細胞特異的に発現する遺伝子(pgl-1)や、生殖細胞を含む全身で発現する遺伝子(eft-3)のイントロンに移植した場合のみ、後期世代においてもテロメアが野生型と同じレベルの長さに維持されていた(右図)。Chr:Chromosomeの略で染色体。
nmy-2遺伝子も、生殖細胞で発現が亢進(こうしん)することが知られており、これらの実験結果を併せて考えると、terc-1が生殖系列で活性化する遺伝子のイントロンに「ヒッチハイク」することで、ホスト遺伝子のプロモーター[10]依存的に発現し、スプライシング過程を経て成熟し、生殖細胞におけるテロメアの伸長を担保しているという、大変巧妙な種の生存戦略が浮かび上がってきました。
また、生殖腺だけで特異的に発現するpgl-1遺伝子のイントロンに移植した場合でもテロメアが経世代的に維持されたことから(図5)、C. elegansでは生殖細胞以外の全身の細胞のテロメアを維持する上で、生殖腺におけるテロメレースの活性化が必要十分であることも同時に証明されました。
今後の期待
テロメレース活性化のメカニズムはこれまで細胞のがん化との関連で盛んに研究されてきましたが、本研究を皮切りに、正常な生体内におけるテロメレース活性化制御の研究が進展することが期待されます。テロメレースの活性化は幹細胞の維持や種の存続に必須であり、その制御メカニズムの解明は基礎生物学および医学的な観点から今後重要な課題といえます。
本研究で見つかったnmy-2遺伝子イントロン中のテロメレースRNA様の配列は、C. elegansのみならず、近縁種のC. briggsaeやC. japonicaにおいても存在することから、イントロン・ヒッチハイクによるテロメレースRNA発現制御は線虫類に広く保存されたメカニズムであると考えられます。一つの仮説として、タンパク質をコードしない機能的RNAを組織特異的に発現させる仕組みとして、イントロン・ヒッチハイクはテロメレースRNAにとどまらず、経世代的なエピジェネティック形質の遺伝や生殖細胞の発生に機能する非コードRNAやsmall RNA[3]などにも同様に用いられている可能性があります。本研究から浮かび上がったこの新たな問いを追究することで、世代を超えて(進化のレベルでは種を超えて)生物が存続する「連続性」の秘密が解き明かされていくことが期待されます。
補足説明
- 1.線虫
線形動物門に属する体長1mmほどの多細胞生物。総細胞数がわずか1,000個と少数ながら、消化器官・神経・筋肉・生殖組織など、動物の基本的な構造を備えている。さらに世代時間が3日と短いことから、寿命研究のモデル動物としても利用されている。 - 2.テロメレース、テロメア
DNA合成酵素は鋳型鎖の末端までDNAを複製することができないため、DNAは複製のたびに少しずつ短くなっていく。しかし、真核細胞のゲノムDNA末端には特徴的な繰り返し配列が存在し、こうした末端の短縮が直ちに遺伝情報に影響を与えないようになっている。この末端配列と、染色体末端を保護するタンパク質から成る構造をテロメアと呼ぶ。また、テロメアDNAを伸長する酵素をテロメレース(テロメラーゼ)と呼ぶ。 - 3.イントロン、ジャンク配列、長鎖非コードRNA、small RNA
ゲノムDNAの配列のうち、遺伝子として機能する以外の機能不明な配列はしばしばジャンク(がらくた)と呼ばれる。ヒトゲノムの場合、全ゲノムの3分の2は転写されていると推定されているが、そのうちタンパク質の配列情報がコードされた領域(エキソンと呼ばれる)はごくわずかであり、mRNAが成熟する過程で切り離され分解される配列(イントロン)など、タンパク質情報を持たない「非コードRNA」が大半を占める。長鎖非コードRNAは、非コードRNAのうち200塩基よりも長いものを指し、このうちイントロンに存在するものを特に長鎖非コードRNA(intronic long non-coding RNA)と呼ぶ。一方、長さが20~30塩基程度の短い非コードRNAをsmall RNAと呼ぶ。 - 4.ホロ酵素
タンパク質成分の他に、活性に必要な非タンパク質成分を含む酵素。テロメレースはタンパク質と鋳型RNAから成るホロ酵素に分類される。 - 5.逆転写反応
RNAを鋳型にして相補的なDNAを合成する酵素反応。 - 6.eCLIP法
タンパク質とそこに結合するRNAを生体内において架橋し、その後目的のタンパク質を結合RNAと共に精製する手法。精製されたRNAは、配列が読まれた後、ゲノム上にマッピングされる。これにより目的のタンパク質に結合するRNAの塩基配列とそのRNAをコードするDNA領域が網羅的に決定される。 - 7.モータータンパク質、nmy-2
ミオシンのように、細胞内でアデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をするタンパク質をモータータンパク質と呼ぶ。nmy-2は、線虫の生殖細胞などで発現する非筋肉型ミオシン遺伝子。 - 8.鋳型配列
テロメレースがテロメアを合成する際に鋳型として用いられるRNA配列。テロメアDNA配列と相補的な10塩基程度のRNA配列がこの鋳型配列として機能する。 - 9.スプライシング
遺伝子が発現する過程で、DNAからRNAが転写されたのち、ジャンク配列であるイントロンが切り離される過程を指す。スプライシングにより、RNAはタンパク質などをコードするエキソン領域だけがつなぎ合わされた成熟RNAになる。一方、スプライシングで切り離されたイントロンは、通常分解されて捨てられる。 - 10.プロモーター
DNA上で遺伝子の上流に存在し、遺伝子の転写のスイッチとして機能する配列。ある遺伝子が組織特異的に発現する場合、このプロモーター配列が組織特異的な転写のon/offを決定していることが多い。
国際共同研究グループ
理化学研究所
生命機能科学研究センター
配偶子形成研究チーム
チームディレクター 澁谷 大輝(シブヤ・ヒロキ)
基礎科学特別研究員 竹田 穣(タケダ・ユタカ)
研究員 石田 森衛(イシダ・モリエ)
テクニカルスタッフⅠ 梶川 絵理子(カジカワ・エリコ)
発生ゲノムシステム研究チーム
チームディレクター 近藤 武史(コンドウ・タケフミ)
技師 西村 理(ニシムラ・オサム)
技師 門田 満隆(カドタ・ミツタカ)
生命医科学研究センター
高機能生体分子開発チーム
チームディレクター 田上 俊輔(タガミ・シュンスケ)
東京大学
定量生命科学研究所
教授 齊藤 博英(サイトウ・ヒロヒデ)
講師 吉井 達之(ヨシイ・タツユキ)
特任助教 角 俊輔(スミ・シュンスケ)
大学院工学系研究科
特別研究学生 井藤 郁弥(イトウ・フミヤ)
(京都大学大学院 医学研究科 医科学専攻 大学院生)
早稲田大学 理工学術院 先進理工学部
教授 浜田 道昭(ハマダ・ミチアキ)
主任研究員 小野口 真広(オノグチ・マサヒロ)
ヨーテボリ大学(スウェーデン)
博士研究員(研究当時)山本 唯央(ヤマモト・イオ)
博士研究員 ジンジン・ジャン(Jingjing Zhang)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「超世代的テロメアDNA維持機構の解明(研究代表者:澁谷大輝)」、内藤記念科学振興財団、武田科学振興財団による助成を受けて行われました。
原論文情報
- Yutaka Takeda, Masahiro Onoguchi, Fumiya Ito, Io Yamamoto, Shunsuke Sumi, Tatsuyuki Yoshii, Morié Ishida, Eriko Kajikawa, Jingjing Zhang, Osamu Nishimura, Mitsutaka Kadota, Shunsuke Tagami, Takefumi Kondo, Hirohide Saito, Michiaki Hamada, and Hiroki Shibuya, "Nematode telomerase RNA hitchhikes on introns of germline-up-regulated genes", Science, 10.1126/science.ads7778
発表者
理化学研究所
生命機能科学研究センター
配偶子形成研究チーム
基礎科学特別研究員 竹田 穣(タケダ・ユタカ)
研究員 石田 森衛(イシダ・モリエ)
テクニカルスタッフⅠ 梶川 絵理子(カジカワ・エリコ)
チームディレクター 澁谷 大輝(シブヤ・ヒロキ)
発生ゲノムシステム研究チーム
チームディレクター 近藤 武史(コンドウ・タケフミ)
生命医科学研究センター
高機能生体分子開発チーム
チームディレクター 田上 俊輔(タガミ・シュンスケ)
東京大学 定量生命科学研究所
教授 齊藤 博英(サイトウ・ヒロヒデ)
早稲田大学 理工学術院
教授 浜田 道昭(ハマダ・ミチアキ)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
東京大学 定量生命科学研究所 総務チーム
Tel: 03-5841-7813
Email: soumu@iqb.u-tokyo.ac.jp
早稲田大学 広報室
Tel: 03-3202-5454
Email: koho@list.waseda.jp
