生命の設計図、ゲノムDNAは糸巻きのようなタンパク質に巻き付いて、細胞の核の中にコンパクトに収納されています。DNAの中にある遺伝子を読み取るときにはDNAを糸巻きから外す必要がありますが、外した後の糸巻きがどうなるかは謎でした。関根 俊一 チームリーダーらの研究グループは、外れた糸巻きが元通りになるまでの一連の過程を撮影することに成功し、この謎を解決に導きました。
遺伝子発現に潜む謎
私たちの細胞の中にある染色体46本分のDNAを全部つなぐと、約2メートルの長さになる。DNAは「ヒストン」というタンパク質に2周ほど巻き付いて「ヌクレオソーム」という小さな構造をつくる。膨大な数のヌクレオソームが数珠つなぎになったものが「クロマチン」である。「クロマチン構造は、長大なDNAを小さな核の中に収納する仕組みであるとともに、DNAのどの部分をいつ働かせるかということを制御する重要な機能を担っています」
DNAにはさまざまな遺伝子の情報が書かれている。遺伝子を利用する(発現させる)には、DNA上の必要な部分の情報を読み取って、RNAをつくる(転写する)必要がある。そのためには、RNAをつくる酵素(RNAポリメラーゼ)がDNAに結合しなければならない。RNAポリメラーゼがいつどこに結合するかの情報はDNAに書かれている。実はヒストンにも、自分に巻き付いているDNAのところにRNAポリメラーゼを呼び込む(あるいは遠ざける)ための情報が載っている。「エピジェネティクス」と呼ばれる遺伝子発現制御の仕組みだ。
RNAポリメラーゼが転写を行う際には、ヒストンは一度DNAから外れなければならない。ただし、外れたヒストンがまた同じDNA領域に結合しないと、エピジェネティクスの仕組みを維持できない。そのため、外れたヒストンを元通りにする何らかの仕組みがあるはずだが、その仕組みは長年、不明だった。
一度壊された後、復元された現場を押さえた!
2022年8月、この謎がついに解明された。関根 チームリーダーらの研究グループが、転写の際にヌクレオソーム構造が一度解体されたり、元通りに復元されたりしている一連の過程を「撮影」することに成功したのだ。
実際に撮影した画像が図1である。一つ一つの粒子は、RNAポリメラーゼやヌクレオソーム、およびその両者が結合したものだ。RNAポリメラーゼが、これからDNAを読み進めようとするところや、ヌクレオソーム構造が復元されるところなど、転写のさまざまな段階が写っている。これらの粒子を基に立体構造を導き出し、転写のどの段階であるかを特定してから、反応の進行順に並べると、転写の一連の過程のコマ撮り写真が出来上がる。

図1 転写の現場を捉えた画像とクライオ電子顕微鏡解析
(左)クライオ電子顕微鏡で撮影された画像。画像の横幅は約0.5マイクロメートル。この画像中には約200個の粒子(反応中の酵素やヌクレオソーム)が写っている。(右上)多数の画像から、同じ種類、同じ向きの粒子を集めて得られた二次元平均像。(右下)三次元再構成によって得られた密度マップ。
今回の研究では、RNAポリメラーゼと複数のタンパク質が連携しながら、ヒストンからDNAを剥がす様子や、転写後に再びヒストンにDNAが巻き付く様子などを捉えることができた。こうして、ヌクレオソーム構造を維持しながら転写を行う一連の仕組みを、解明したのだ(図2)。
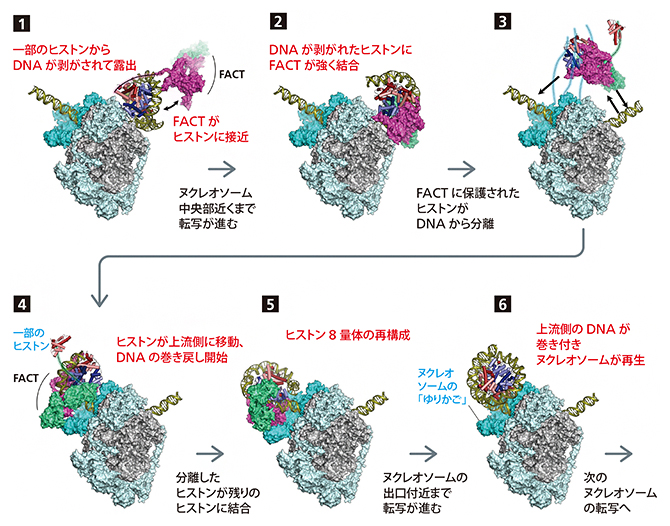
図2 ヌクレオソームの解体と復元
一度DNAから外れたヒストンに、再びDNAが巻き付くまで。実際に撮影された写真から、各段階の形が明らかになった。
FACT: 補助因子( ヒストンシャペロン)
反応中の酵素やDNAを凍らせて撮影
画像の撮影には、観察対象を凍らせたうえで原子レベルの極小の世界を観察できる「クライオ電子顕微鏡」(プロフィール写真の背後の装置)が使われた。関根 チームリーダーらはまず、一連の反応を起こすために必要なDNAやヒストン、RNAポリメラーゼなどを試験管に入れて、実際に細胞の中で転写が起きている様子を再構成した。そして、反応中の溶液をごく薄い氷の中に瞬間的に凍結し、ヌクレオソーム構造を閉じ込めた上で撮影を試みた。こうして撮影したのが図1左の画像というわけだ。撮影した画像をコンピュータで解析し、高精度の立体構造を導き出すことで、それらがどのような反応段階のものであるかが特定できる(図1右)。
クライオ電子顕微鏡では、1種類のタンパク質だけを凍らせて撮影することが多い。1種類のタンパク質の一つの構造だけであれば、画像の解析もしやすく、少ない撮影枚数でもそのタンパク質の構造について十分な情報が得られる。
しかし、今回の実験で撮影したのはDNAとヒストン、RNAポリメラーゼに加えて、10以上のタンパク質。ただでさえ多い"登場人物"がいろいろな組み合わせでさまざまな転写反応の段階にあるので、狙った反応段階が1枚の画像中に写る確率は低くなる。そのため、転写の各段階のデータをそろえるためには、大量の画像が必要となってくる。最終的に今回の実験では、図1のような画像を十数万枚も撮影した。
成果の裏に、研究の蓄積あり
今回の研究は、東京大学の胡桃坂 仁志 教授らの研究グループと共同で行われた。関根 チームリーダーらはRNAポリメラーゼ、胡桃坂 教授らはヌクレオソームの研究を長年行ってきた。「両者の得意分野が相乗効果を発揮して、今回の世界初の成果につながったのだと思います」
今後は"登場人物"をさらに増やして撮影に挑む予定だ。「今回の解析で、結合した状態は分かったのですが何の役に立っているか分からないものがあります。さらに、今回使った材料のほかにも、実際の転写にはもっと多くの因子が関与しています。それらの因子を増やして反応させたり、ヒストンの状態を変化させたうえで反応させたりして、さらに詳しく転写の仕組みを明らかにしたいと考えています」
転写に異常が生じると、がんなどの病気や老化につながることが指摘されている。「今後も生物学の根本的な問題に答えて、教科書を書き換えるような仕事をしていきたいですね。生物の基本的なメカニズムの理解が進むことで、病気や老化の理解にもきっと役立つはずです」
(取材・構成:福田 伊佐央/撮影:古末 拓也/制作協力:サイテック・コミュニケーションズ)
関連リンク
- 2022年8月19日プレスリリース「遺伝子の発現とクロマチン構造の維持を両立させる仕組み」
この記事の評価を5段階でご回答ください

