2010年5月28日
独立行政法人 理化学研究所
薬剤の生体内標的分子を予測するプロテオミクスシステムを構築
-2D-DIGEのプロテオーム解析が、薬剤候補化合物の標的分子を推定-
ポイント
- 二次元電気泳動を用いたプロテオミクスで、薬剤となる化合物の生体作用を解析
- 薬剤候補化合物を、作用する生体内の標的分子別、機序別に分類することが可能に
- 想定外の標的推定も可能、薬の副作用軽減や新薬開発へ貢献
要旨
独立行政法人理化学研究所(野依良治理事長)は、二次元電気泳動法※1を用いたプロテオミクス※2を活用して、薬剤候補と期待される化合物が引き起こす細胞内のプロテオーム※2の変化を調べる手法で、これら化合物の生体内標的分子の推定や、作用機序別の分類が可能なことを初めて明らかにしました。これは、理研基幹研究所(玉尾皓平所長)ケミカルバイオロジー研究基盤施設の長田裕之施設長、室井誠先任研究員と、筑波大学大学院生物環境科学研究科の臼井健郎准教授との共同研究による成果です。
普段服用している薬でも、標的分子が最近まで不明であったり、いまだに標的分子が分からないままであったりする薬が多数存在しています。しかし、近年発展した遺伝子情報の利用や分子レベルでの解析技術の進歩によって、病巣など生体内の標的分子を創薬の段階から定めた、分子標的治療薬と呼ばれる新しい薬の開発手法が実施されるようになってきました。より効果的で副作用の少ない薬剤を開発するためには、薬剤の生体内標的分子を明らかにすることが不可欠です。しかし、この標的分子の同定には、細胞内の多種多様なタンパク質や複雑なネットワークの存在、標的分子の動的な立体構造などが原因で、非常に多くの時間と労力が費やされています。
研究グループは、代表的な培養細胞で、ヒト子宮頸(けい)がん由来のがん細胞の1種であるHeLa細胞※3に、抗がん作用の知られているゲルダナマイシンをはじめ、生体内標的分子が既知である薬剤などの化合物19種類をそれぞれ添加しました。その結果、添加した化合物の影響で生じる細胞内のさまざまなタンパク質の発現量の変化を、サンプルごとに異なる蛍光色素で標識して解析する蛍光標識二次元ディファレンスゲル電気泳動解析システム(2D-DIGE)※4を用いて調べて化合物間で比較したところ、同じ標的分子を持つ化合物は似たパターンを示すことが分かりました。また、標的分子が同じでも作用機序が違う化合物では、違うパターンを示すことも分かりました。
この新たに構築した解析手法は、化合物を生体内標的分子別や作用機序別に分類・分析し、新規化合物の標的分子の迅速な特定、さらには、より効率的な創薬に貢献すると期待されます。
本研究成果は、米国の科学雑誌『Chemistry and Biology』(5月28日号)に掲載されます。
背景
がんをはじめとする疾病の治療薬の基となる多くの化合物は、細胞を使った評価系を用いて探索されていますが、こうして得た化合物が直接相互作用する生体内の標的分子は不明のままです。化合物が作用する標的分子を明らかにすることは、より効果的な薬剤の開発や、副作用の軽減に役立ちます。しかし、標的分子を特定する過程は、化合物の構造情報や、細胞に及ぼす作用を詳細に調べて、ようやくたどり着くという、非常に時間と労力を費やすものでした。そこで、この過程の効率化や加速化のために、がんを対象として米国のNIH(国立衛生研究所)や日本の癌化学療法センターでは、化合物が示すがん細胞への感受性に基づき、新規化合物と標的分子の相互作用が既知の化合物の相互作用とどのくらい似ているかを評価する解析系を構築し、標的分子の同定に成果をあげてきました。近年になると、遺伝子発現やタンパク質発現を網羅的に解析するオミックス※5の技術が進歩し、化合物を添加したときに細胞が示すさまざまな応答を、網羅的に一度で検出することが可能になりました。
研究グループは、こうして得られる大量の情報を利用し、より多種多様な化合物を評価することができる解析系の構築を目指しました。特に、細胞内での反応の直接の担い手であるタンパク質の発現量の変化や、修飾などの質的な変化を解析することができる蛍光標識二次元ディファレンスゲル電気泳動解析システム(2D-DIGE)を使って、薬剤候補化合物の評価や標的分子の推定を可能とする解析系の構築を試みました。
研究手法
ヒト培養細胞であるHeLa細胞を培養した培養液に、抗がん作用の知られているゲルダナマイシンなど、標的分子が明らかな19種類の化合物を別々に加え、37℃18時間で培養しました。その後、培養液を分離して得た細胞に、界面活性剤を含む緩衝液を加えて可溶化し、細胞内の全タンパク質を蛍光色素で標識した後、二次元電気泳動法でタンパク質を分子量と等電点によりに泳動ゲル上にスポットとして分離しました。分離したタンパク質の量を蛍光スキャナーで読み取って定量化し(図1A)、階層的クラスター解析※6を行うことによって、化合物間の類似度の比較を実施しました(図1B)。さらに、化合物添加によって特徴的に変化したスポットを泳動ゲルから切り出し、そこに含まれるタンパク質を、質量分析装置を用いたペプチドマスフィンガープリンティング法※7で同定しました。
研究成果
がん細胞に対する標的分子の1つに、熱ショックタンパク質※890(HSP90)というタンパク質の折りたたみを助ける細胞内タンパク質(シャペロン)があります。このHSP90に結合する阻害剤として知られるゲルダナマイシンが、HeLa細胞のプロテオームへ及ぼす作用を2D-DIGE法で調べました。すると、すでに報告されているとおり、HSP70やHSP27というほかの熱ショックタンパク質の顕著な増加を検出したのに加え、eukaryotic elongation factor 2、protein disulfide isomeraseなどのタンパク質だけでなく、未同定のタンパク質のスポットについても特徴的な発現量の増減のパターンを検出することができました。また、標的分子は同じHSP90ですが、分子構造の異なる化合物ラディシコールでもゲルダナマイシンの時と同様な増減のパターンを示しました。そこで、標的分子が明らかな19種類の化合物に関して解析したところ、HSP90阻害剤と同様に、チューブリン※9阻害剤や液胞型ATPアーゼ※10阻害剤など、同じ標的分子を対象にした化合物は、それぞれが似たパターンを示すことが分かりました(図2)。また、がん細胞の増殖抑制作用の知られているイエジマライドA、Bは、すでに研究チームが液胞型ATPアーゼを直接阻害することを明らかにしていましたが、ほかの液胞型ATPアーゼ阻害剤と類似したパターンを示すことも分かりました。つまり、2D-DIGE法によって、投与した化合物を標的分子ごとに分類することに成功しました。また、DNAの2重らせん構造のねじれを調節するトポイソメラーゼ※11の機能解析に用いられるICRF-193と、抗がん剤として使用されるエトポシドは、ともにトポイソメラーゼII阻害剤ではあるものの、阻害機序が異なっていることが知られています。これらの化合物についても2D-DIGEの解析を行ったところ異なったクラスターに分類することができたため、この手法が、作用機序の違いも区別することができる可能性があると分かりました。
今後の期待
さまざまな化合物の解析結果をデータベース化し、新規化合物がどの化合物と似たパターンを示すかを比較すると、その化合物の生体内標的分子の迅速な同定につながり、より効果の高い薬剤を効率的に開発できると期待されます。また、本来想定されていない化合物の標的(オフターゲット)を検出することで、薬剤の副作用などを軽減する研究開発にも貢献すると期待できます。
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究基盤施設
施設長 長田 裕之(おさだ ひろゆき)
先任研究員 室井 誠(むろい まこと)
Tel: 048-467-4839 / Fax: 048-462-4669
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.二次元電気泳動法
タンパク質やDNAのような分子・粒子が電場中で移動することを利用して分離する方法を電気泳動法という。2段階の電気泳動によりタンパク質などを分離する手法が二次元電気泳動法である。タンパク質の分離では、1次元目で等電点電気泳動、二次元目でSDSポリアクリルアミド電気泳動による、二次元電気泳動が一般的に行なわれ、数千のスポットとしてタンパク質を分離できる。 - 2.プロテオミクス、プロテオーム
細胞など、生物のある状態において存在するタンパク質の全てをプロテオームという。プロテオーム(proteome)という言葉は、タンパク質を表すproteinと全体を表す-omeから作られた言葉である。ゲノム情報を基に合成されたタンパク質は細胞内で実際に機能を担っており、細胞の状態によって変化することから、プロテオームの解析は生命現象を解析する上で重要であると考えられる。プロテオミクスとは、プロテオーム解析、ならびに、プロテオームを解析する技術を指す。 - 3.HeLa細胞
世界で初めて樹立されたヒトの細胞株(生体外で一定の性質を持って長期間培養できる細胞)。子宮頸(けい)がん由来の細胞で、世界中でさまざまな研究に利用されている。名前は、患者である黒人女性の名前(Henrietta Lacks)に由来する。 - 4.蛍光標識二次元ディファレンスゲル電気泳動解析システム(2D-DIGE)
プロテオーム解析を行なう方法の1つ。比較するサンプル中のタンパク質を異なる蛍光色素で標識したあと、二次元電気泳動でタンパク質を分離する。分離されたタンパク質スポットを蛍光スキャナーで解析することによってサンプルに含まれるタンパク質の量比を精度よく測定できる。 - 5.オミックス
ゲノム解読が完了して以来、遺伝子の網羅的な発現情報(トランスクリプトーム)や細胞内のタンパク質(プロテオーム)、細胞内の代謝物(メタボローム)などさまざまな種類の網羅的分子情報の収集・解析が急速に発展してきた。このような生物の体の中にある分子全体を網羅的に調べる学問をオミックスという。 - 6.階層的クラスター解析
複数の変数からなるデータを統計的に扱う方法を多変量解析といい、クラスター解析、主成分分析などがこれにあたる。多くの変数を扱うため手計算では困難であるが、近年コンピュータを利用して容易に解析が可能となった。クラスター解析は複数の変数を用いて、類似度を計算して分類する手法。階層的クラスター解析ではサンプル間でどれくらい双方が似ているかを示す距離を計算して、階層的にグループ化する方法で、結果は樹形図を用いて示される。また、特定のクラスター数に分類する非階層的クラスター解析もある。 - 7.ペプチドマスフィンガープリンティング
タンパク質の同定法の1つ。分離されたタンパク質をトリプシンなどのプロテアーゼでペプチドに分解し、その質量をMALDI-TOFなどの質量分析法で測定する。測定したペプチドの質量をデータベース内の理論値と比較することによって、統計的に最も有意なタンパク質を選び出し、同定する方法。 - 8.熱ショックタンパク質
細胞が熱などのストレスにさらされた時に発現が上昇してくる一連のタンパク質。代表的なものにHSP90、HSP70、HSP60などが知られており、これらのタンパク質は分子シャペロンとして、立体構造の正しくないタンパク質などに結合して会合形成を防いだり、再生を促したりする。HSP90は細胞の増殖に関するシグナル伝達系にかかわるタンパク質の安定性にも寄与しており、HSP90阻害剤はがん細胞の増殖におけるシグナル伝達経路を阻害することでがん細胞の増殖を抑制すると考えられている。 - 9.チューブリン
真核生物の細胞内にあるタンパク質で、微小管や中心体の構成成分。チューブリンは規則正しく重合することによって微小管を形成するが、微小管形成は細胞分裂にも密接に関与しており、がん細胞の増殖の標的となる為、チューブリン阻害剤は抗がん剤としても用いられている。 - 10.液胞型ATPアーゼ
細胞内小器官の内部の酸性化を担うほか、破骨細胞の細胞表層に局在して骨の再構築に深く関与している。がん細胞の薬剤耐性、アポトーシス抵抗性、転移の過程にも深く関与していると推測されることから、がんの標的分子として研究が進められている。 - 11.トポイソメラーゼ
2本鎖DNAは2重らせん構造を形成している。転写、複製、修復の際には2重らせん構造をほどく必要があるが、その際に問題になるねじれを調節しているのがトポイソメラーゼである。DNAの1本だけを切断する酵素をトポイソメラーゼI、2本とも切断する酵素をトポイソメラーゼIIという。トポイソメラーゼIIの阻害剤であるエトポシドは抗がん剤として使用されている。
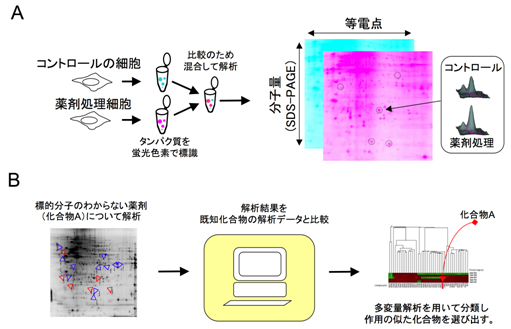
図1 2D-DIGEを用いたプロテオーム解析法と解析結果の薬剤間の比較
(A) 薬剤処理した細胞と対照(コントロール)となる細胞を、それぞれ異なる蛍光色素で染色した後、混ぜて二次元電気泳動を行なう。二次元電気泳動ゲル上で分離されたタンパク質のスポットについて、蛍光スキャナーを用いて色素を別々に定量化し、精度良くサンプルの量を比較する。
(B) 開発中の薬の候補で標的分子の明らかでない化合物について、2D-DIGE法を用いて解析を行う。取得した結果を既知の化合物のデータと比較するため、階層的クラスター解析を行い、最も似ている化合物を選ぶ。この類似の化合物が作用する標的分子、または、それに近い分子との相互作用を検証することで、薬剤候補化合物の標的分子を明らかにする。
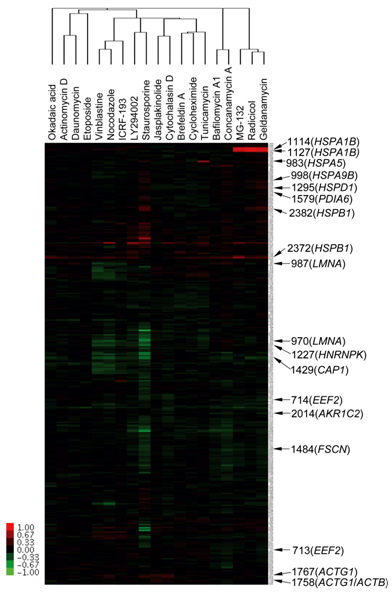
図2 プロテオーム解析を用いた19標準化合物の分類
19個の標的分子の明らかな化合物をそれぞれHeLa細胞に添加した後、蛍光標識二次元ディファレンスゲル電気泳動解析システム(2D-DIGE)と階層的クラスター解析を行ない、その結果を樹形図で示した。HSP90阻害剤(Geldanamycin, Radicicol)、チューブリン阻害剤(Nocodazole, Vinblastine)、液胞型ATPアーゼ阻害剤(Bafilomycin A1, Concanamycin)のように、標的分子が同じ化合物は、樹形図上でお互いに近い場所に位置することが分かる。
