2011年7月19日
独立行政法人 理化学研究所
2型糖尿病に関わるグルコース輸送体「GLUT4」上の糖鎖の機能を解明
-たった1つのN型糖鎖がインスリンに応答した血糖値調節を左右する-
ポイント
- N型糖鎖の付加がインスリンに応答するグルコース輸送体の「品質管理」に重要
- N型糖鎖の構造は、GLUT4が正しい経路で細胞膜へ輸送されるための「目印
- 血糖値を調節する仕組みや糖尿病発症に糖鎖が果たす役割の解明に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、2型糖尿病に関わるグルコース輸送体「GLUT4」上のN型糖鎖※1が、タンパク質の安定性とインスリンへの正しい応答に重要であることを初めて発見しました。これは、理研基幹研究所(玉尾皓平所長)糖鎖代謝学研究チームの鈴木匡チームリーダー、芳賀淑美日本学術振興会特別研究員らによる成果です。
糖尿病の一種である2型糖尿病は根本的な治療法が無く、具体的な発症の仕組みも十分に解明されていません。その治療法を開発するには、膵(すい)臓が分泌するインスリンに応答して、細胞ではどのようなことが起こるのかを解明することが必要です。2型糖尿病になると、血液中のグルコース(ブドウ糖)が正常に細胞内に取り込まれず、血糖値が上昇したままになります。インスリンに応答して血糖値を保つために重要な役割を果たしているのが、グルコース輸送体「GLUT4」です。通常GLUT4は、細胞内の特殊な小胞※2(GLUT4小胞)に蓄積しており、インスリンの刺激に応答して細胞膜に輸送され、血中のグルコースを細胞内に取り込みます。
一般に、細胞膜に存在する膜タンパク質のほとんどは糖鎖が付加されており、この糖鎖がさまざまな生理的・病理的現象に関わっていることは広く知られています。GLUT4もN型糖鎖が1カ所付加されていますが、その性質や機能にどう影響するのかは全く不明のままでした。
研究チームは、N型糖鎖の付加されないGLUT4は、付加された場合に比べて分解が速いことを明らかにし、N型糖鎖がGLUT4の品質管理に重要な役割を果たしていることを見いだしました。さらに、GLUT4がGLUT4小胞に蓄積してインスリンに応答するには、N型糖鎖の正しい構造が必要であることも発見しました。これは、GLUT4が正しい経路を経て細胞膜へと輸送される際に、糖鎖が「目印」となっている可能性を示しており、血糖値の恒常性維持の仕組みを理解するための大きな一歩となります。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』(9月号)に掲載されるに先立ち、オンライン版(7月14日付け:日本時間7月15日)に掲載されました。
背景
糖の一種であるグルコース(ブドウ糖)は、細胞のエネルギー源として生物に必須の栄養素です。血液中のグルコース濃度はさまざまなホルモンの働きによって常に一定となる(恒常性)ように調節されていますが、最近の研究から、血糖の恒常性維持の仕組みが徐々に明らかになってきました。例えば、膵(すい)臓が分泌するインスリンがインスリン受容体に結合し、細胞内にその情報が伝わると、グルコース輸送体「GLUT4」が細胞表面に移動して血液中のグルコースを細胞内に取り込み、血糖の恒常性を保つことが分かってきました。また、インスリンの刺激のない状態ではGLUT4は細胞内の特殊な小胞(GLUT4小胞)に蓄積しており、その小胞への局在がGLUT4のインスリン応答性に重要であることも示されてきました(図1)。
世界的に患者数が増加傾向にある糖尿病は、このような血糖値の恒常性維持機構が破綻し、血液中のグルコースが細胞内に取り込まれなくなって血糖値が上昇する病気です。1型と2型がある糖尿病のうち、インスリンの分泌能の低下や、インスリン感受性の低下によって引き起こされるのが2型糖尿病です。GLUT4は血糖の恒常性維持に重要な役割を果たしているため、その機能の変質が2型糖尿病の発症に関与すると考えられています。しかし、インスリンに応答して引き起こされる細胞内の情報伝達機構は複雑で、グルコースの取り込みの仕組みはいまだに不明な点が多く残っています。
生体内でしばしば細胞の顔に例えられる糖鎖は、細胞間の認識、細胞の分裂増殖、がん化、受精、ホルモンやウイルス・毒素との結合など、さまざまな生理的、病理的現象に深く関与しています。特に、N型糖鎖は、正しく折り畳まれたタンパク質と異常なタンパク質を判別するための目印となったり、タンパク質の安定性や細胞内への取り込みに影響を与えたりすることが知られています。GLUT4もまた、N型糖鎖を1カ所付加されています。GLUT4がインスリンに応答する仕組みについては古くから研究されてきましたが、このN型糖鎖がGLUT4による血中グルコースの取り込みにどのように影響するかは、これまで全く調べられていませんでした。
研究手法と成果
研究チームは、GLUT4の性質にN型糖鎖が及ぼす影響を明らかにするため、緑色蛍光タンパク質(GFP)※3を融合させた野生型GLUT4と、その糖鎖欠損変異体(N57Q変異体)を作製し、ヒト子宮頸がん由来細胞(HeLa細胞※4)に発現させて解析を行いました。GFPを融合すると、GLUT4の機能を損なうことなく、細胞内でのGLUT4の動きを簡単に可視化することができます。その結果、N型糖鎖が付加した野生型GLUT4は安定化しますが、糖鎖が付加しないN57Q変異体は不安定化して、小胞体関連分解(ERAD)※5で分解されることが分かりました。
さらに、GLUT4が細胞膜に移動してくる様子を顕微鏡で観察したところ、野生型GLUT4はインスリンに応答して細胞内小胞―細胞膜間を移動するのに対し、N57Q変異体はインスリンに応答しないことが明らかとなりました(図2)。そこで、GLUT4に糖鎖が付加していることが重要なのか、糖鎖の構造が重要なのかを調べるため、野生型GLUT4を発現した細胞を糖鎖合成ステップの阻害剤で処理し、糖鎖の構造を変化させたGLUT4を作製しました。興味深いことに、糖鎖構造を変化させたGLUT4も、N57Q変異体と同様にインスリンに応答しなくなることを確認しました。
一般に、細胞内で合成された膜タンパク質は、エンドソームという小胞によって細胞膜へと輸送され、この経路にはインスリン刺激は影響しません(図3a)。一方、正しいN型糖鎖が付加されたGLUT4など、いくつかの選ばれた膜タンパク質は、エンドソームからGLUT4小胞に移動、蓄積され、インスリンの刺激に応じて細胞膜に移動することが知られています(図3b)。しかし、糖鎖構造を変えたGLUT4や糖鎖を欠失したGLUT4は、GLUT4小胞を経た経路を通らず、エンドソームから直接細胞膜へと移動するため、インスリンに応答することができないと考えられます(図3c)。つまり、GLUT4に付いたN型糖鎖は、正しい経路をたどるための「目印」となっていることを示しています。さらに、血液中のグルコースを細胞内へと運ぶ性質(グルコース輸送活性)について調べてみると、糖鎖付加の有無による差は見いだせませんでした。
これらの結果から、GLUT4に付加したN型糖鎖は、グルコース輸送活性へは影響しませんが、GLUT4の品質管理と、インスリンに応答するためのGLUT4小胞への蓄積には重要であることが明らかとなりました。
今後の期待
今回、GLUT4がインスリンに応答する正しい経路を通るために、たった1つのN型糖鎖付加がその目印となる可能性を示したことは、2型糖尿病の発症の仕組みを理解する上で大きな発見です。
今後、糖鎖の構造を認識する分子を同定し、選別輸送の仕組みを解明する必要があります。また、糖尿病罹患者のタンパク質の糖鎖構造を調べたところ、健常人とは異なっていたという報告があります。そのため、糖尿病罹患者のもつGLUT4の糖鎖構造が注目されます。特定の糖鎖構造を認識する制御因子が明らかになれば、糖尿病の原因究明に役立つ新たな知見を得られると期待できます。
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域 システム糖鎖生物学研究グループ 糖鎖代謝学研究チーム
チームリーダー 鈴木 匡(すずき ただし)
Tel: 048-467-9628 / Fax: 048-467-9626
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.N型糖鎖
タンパク質中のアスパラギン残基に結合する糖鎖。 - 2.小胞
細胞内に形成される膜に包まれた袋状の構造物のこと。小胞によるタンパク質を含む物質輸送は小胞輸送と呼ばれる。 - 3.緑色蛍光タンパク質(GFP)
Green Fluorescent Protein。下村脩博士が1960年にオワンクラゲから見つけた分子量約27kDaの蛍光タンパク質。生きた細胞内で、特定の場所や機能しているタンパク質を発光させることができる。このため、細胞生物学、発生生物学、神経細胞生物学などの分野で最も広く利用されている。2008年、下村脩ボストン大名誉教授ら3博士が、「緑色蛍光たんぱく質(GFP)の発見と発光機構の解明」によってノーベル化学賞を授与された。 - 4.HeLa細胞
世界で初めて樹立されたヒトの細胞株(生体外で一定の性質を持って長期間培養できる細胞)。子宮頸(けい)がん由来の細胞で、世界中でさまざまな研究に利用されている。名前は、患者である黒人女性の名前(Henrietta Lacks)に由来する。 - 5.小胞体関連分解(ERAD)
小胞体で生合成された糖タンパク質が正しい高次構造をとれなかった場合、そのような異常糖タンパク質を小胞体から細胞質へ放出し、分解する機構。細胞小器官の1つである小胞体は、分泌経路にのるタンパク質を合成する場で、N型糖鎖の付加やタンパク質の正しい折り畳みが行われる。
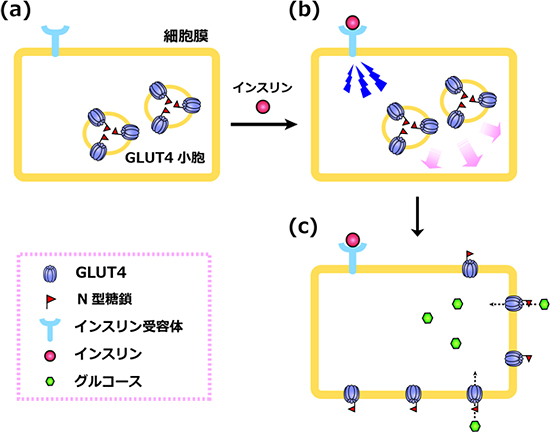
図1 グルコース輸送体GLUT4のインスリンに応答した細胞膜への移行
- (a) 通常、グルコース輸送体GLUT4は、細胞内の特殊な小胞(GLUT4小胞)に蓄積している。
- (b) 細胞膜に存在するインスリン受容体にインスリンが結合すると、細胞内にシグナルが伝わる。
- (c) GLUT4が細胞膜へと移動し、血中のグルコースを細胞内に取り込む。
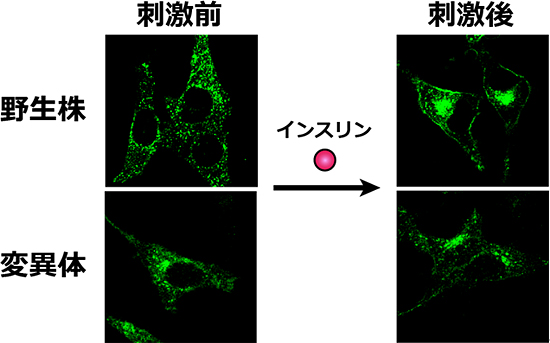
図2 GLUT4のインスリン応答による細胞膜への移行にはN型糖鎖が必要である
GFPを融合させると、GLUT4の機能を損なわずに可視化することができる。野生型では、インスリンによる刺激前は丸い小胞に蓄積していたGLUT4が、刺激後は細胞膜に局在している。一方、N57Q変異体はインスリンの刺激に反応せず、局在が変化しない。
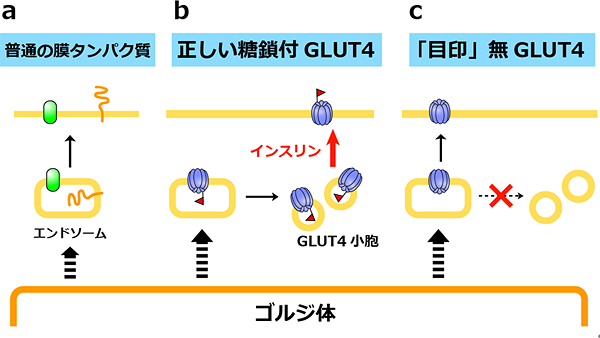
図3 GLUT4の糖鎖に依存した細胞内局在とインスリン応答性の変化
- (a) 新しく合成されたタンパク質はゴルジ体(細胞小器官の1つで数多くの糖転移酵素が存在する)を通って成熟したタンパク質になる。普通の膜タンパク質はゴルジ体からエンドソームという輸送小胞に送られ、細胞膜に達する。
- (b) GLUT4は、エンドソームに送られた後GLUT4小胞に送られ、そこで待機する。インスリン刺激を受けるとGLUT4小胞から細胞膜に移動する。
- (c) 正しい糖鎖構造という「目印」を持たないGLUT4は、GLUT4小胞に行くことができず、普通の膜タンパク質と同じようにエンドソームから直接細胞膜に送られるため、インスリン応答性が無いと考えられる。
