理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの中川英刀チームリーダー、北海道大学大学院医学研究院消化器外科学教室IIの江畑信孝大学院生(現がんゲノム研究チーム客員研究員)と平野聡教授らの共同研究チームは、日本人胆のうがんの全ゲノムシーケンス解析[1]などを行い、胆のうがんの予後に関連する遺伝子やその変異を同定し、その発がん機構の一端を解明しました。
本研究成果により、今後、胆のうがんの詳細な分子生物学的な分類が進展し、その分類に応じて治療方針を決定する個別化医療(がんゲノム医療)が前進すると期待できます。
胆のうは肝臓で産出された胆汁を蓄える器官で、日本人では胆のうがんの発症率が高いことが知られています。しかし、進行胆のうがんでは外科的切除などの治療は難しく、予後は極めて不良です。
今回、共同研究チームは日本人胆のうがん36例について、全ゲノムシーケンス解析、エクソーム解析[2]、RNA発現解析を行い、胆のうがんに関わる分子異常を調べました。その結果、「腫瘍の微小環境[3]」の活性化の有無によってA、B二つの群に分類でき、微小環境が活性化しているB群は再発傾向が強く予後不良であることが分かりました。またB群では、腫瘍細胞周辺の免疫細胞や間質細胞の活動性が上昇しており、TGF-βシグナル[4]や上皮間葉転換(ETM)[5]のパスウェイ[6]関連分子に変異や発現異常が見られ、免疫抑制や腫瘍微小環境との関連が示されました。
本研究は、科学雑誌『Cancers』オンライン版(2月10日付)に掲載されました。
背景
胆のうは、肝臓で産出された胆汁を蓄える器官であり、その上皮細胞から発生した悪性腫瘍が胆のうがんです。一般的には、胆石症や慢性胆のう炎が発生リスクとされていますが、発がん機構の詳細はいまだ不明です。
胆のうがんは世界的にみると稀ですが、アジアや南米において高い頻度で発生し、日本では1年間に約8,200人注1)が発症しています。胆のうがんは転移や浸潤しやすく、周囲に重要な血管が存在する複雑な部位に発生するため、進行胆のうがんの根治的手術は難しい状況です。切除できないことも多く、その場合は5年生存率が3%しかありません注2)。また、非切除例や再発例に対する有効な治療法がないことから、全体での5年生存率は25%と極めて難治性のがんです注1)。
がんはゲノムに変異が蓄積することで発生し、進行する「ゲノムの病気」です。胆のうがんにおいても、これまでがん抑制遺伝子TP53の変異など、さまざまな遺伝子変異が同定されています。しかし、病理学的にも遺伝学的にも多様性に富んでおり、ゲノムが関わる発がん機構はまだ解明されていません。また、がんのゲノム変異を標的とした分子標的治療法や個別化治療のためのゲノム変異マーカーの開発も不十分です。そのため、胆のうがんサンプルを用いた全ゲノムシーケンス解析により得られるゲノム異常情報と臨床病理情報との関連を検討することが求められていました。
- 注1)国立がん研究センターがん情報サービス 胆道がん
- 注2)胆道癌全国登録データよりみた胆嚢癌の動向。胆と膵。36p15-18、2015
研究手法と成果
共同研究チームは、北海道大学病院で切除手術を行った36例の胆のうがんの切除サンプルと正常組織からDNAを抽出し、次世代シーケンサー[7]を用いて、全ゲノムシーケンス解析またはエクソーム解析を行い、遺伝子変異を探しました。また、同時にサンプルからRNAを抽出し、非コードRNA[8]を含む網羅的RNA発現解析も行い、胆のうがんの分子生物学的特性を調べました。その結果、胆のうがんはA、B二つの群に分類できることが分かりました(図1)。B群は、A群に比べて極めて予後不良、再発傾向が強く、間質に活性化した線維芽細胞と免疫抑制機能を持つ免疫細胞が多く観察されました(図2)。
また、遺伝子発現のパスウェイ解析[6]を行ったところ、B群の胆のうがんでは、免疫、TGF-βシグナル、上皮間葉転換(ETM)に関わるパスウェイが活性化していることが分かりました。さらに、A群とB群との間で非コードRNAの発現を比較したところ、B群で複数のマイクロRNA[8]が高発現していました。そこで、その一つmiR125B1を胆のうがん細胞株で欠失させたところ、浸潤能の低下、EMT活性、免疫関連機能、TGF-βシグナルパスウェイの低下が確認されました。
遺伝子変異解析では、TP53遺伝子、ELF3遺伝子、SMAD4遺伝子の変異が見いだされましたが、特にB群の胆のうがんにおいては、TGF-βシグナル関連分子の変異が多数検出されました。したがって、これら変異を介して、TGF-βシグナルパスウェイが活性化し、EMTへの誘導、腫瘍微小環境の形成、免疫抑制の誘導が行われていると考えられます。
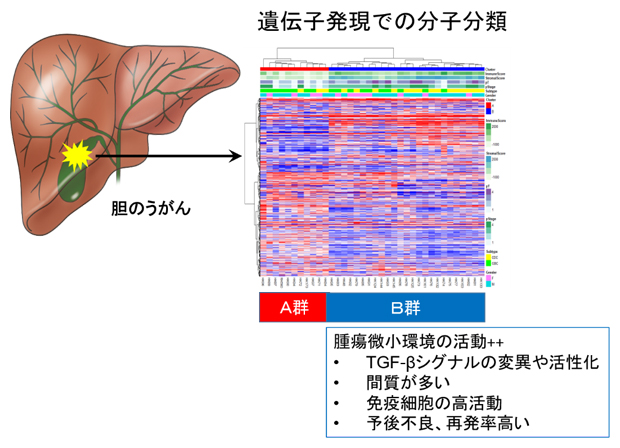
図1 胆のうがんの遺伝子発現解析から明らかになった分子分類
RNA発現解析の結果、胆のうがんはA、B二つのグループに分類できた。B群では間質が多く、腫瘍微小環境や免疫細胞が活性化しており、TGF-βシグナルの変異や活性化も観察された。B群は予後不良で再発率も高かった。
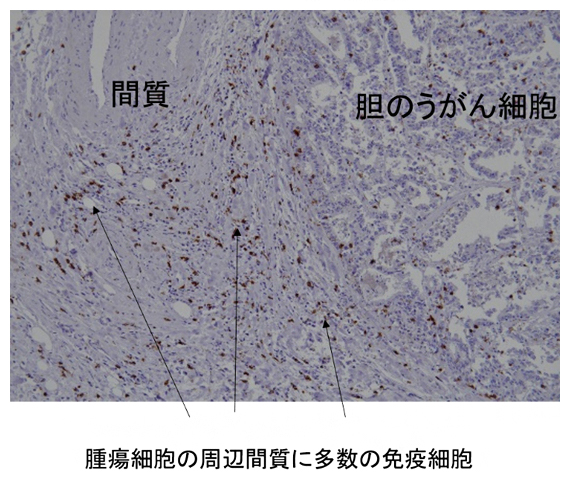
図2 胆脳がんB群の免疫組織染色画像
胆のうがんの間質に、褐色に染色された多数の免疫細胞(CD8+T細胞)が確認された。
今後の期待
今後、本研究で得られた胆のうがんのゲノム情報を用いて、胆のうがんの詳細な分子生物学的分類が進展し、その分類に応じて治療方針を決定する個別化医療(がんゲノム医療)が進むものと期待できます。
また、今回のゲノム解析により同定した胆のうがんの悪性度や予後に関わるさまざまな遺伝子変異や発現異常、そして免疫的な変化は、早期診断法や効果的な治療法がない胆のうがんに対して、これらを標的とした新しい治療法、特に複合免疫療法の開発に貢献すると期待できます。
補足説明
- 1.全ゲノムシーケンス解析
次世代シーケンサーを使って、個人(約30億塩基)やがんの全ゲノム情報を解読し、配列の違いや変化を同定すること。データが大量になるため、スーパーコンピュータを使って情報解析を行うのが一般的である。タンパク質をコードするエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能である。がんの場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシーケンス解析を行い、その差分を調べる。 - 2.エクソーム解析
ゲノムの中のタンパク質に関する情報が書き込まれているエクソン部分(ゲノム全体の1~2%)のDNA配列を、次世代シーケンサーを用いて包括的に解析する方法。 - 3.腫瘍の微小環境
腫瘍組織中には、腫瘍細胞だけでなく線維芽細胞や免疫細胞、血管細胞など非腫瘍細胞が多く存在し、間質を形成している。これらの細胞や環境を総称して腫瘍の微小環境と呼び、腫瘍の成長、化学療法や免疫療法への抵抗性と関連している。 - 4.TGF-βシグナル
細胞の増殖や分化を制御する多機能性サイトカイン。いくつかの受容体と結合することで、SMADなど下流のシグナル伝達系が活性化し、多種多様な遺伝子発現の制御を行う。組織の線維化や免疫抑制機構、腫瘍の微小環境の形成にも関与している。がんでは、TGF-βパスウェイの下流分子をコードするACVR1B、ACVR2A、SMAD2、SMAD3、SMAD4、TGFBR1、TGFBR2などの遺伝子に変異が起こるがある。 - 5.上皮間葉転換(EMT)
上皮細胞が間葉細胞様に形質変化することで、浸潤や転移を促し、また周辺の線維芽細胞などの微小環境を整える機能のこと。EMTはepithelial mesenchymal transition/epithelial to mesenchymal transitionの略。 - 6.パスウェイ、パスウェイ解析
パスウェイとは遺伝子間の連続的な機能的連関のこと。パスウェイを調べて、遺伝子の機能、遺伝子の関係性などを調べる手法をパスウェイ解析という。 - 7.次世代シーケンサー
ヒトゲノムの全配列約30億塩基を解読できる高速高精度の性能を持つシーケンサー。欧米の政府や企業が技術開発を行い、1,000米ドル以下のコストで解読できる。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができ、一回の反応で数十人分の全ゲノムの配列を解析可能。 - 8.非コードRNA、マイクロRNA
非コードRNAはタンパク質をコードしていないRNAのこと。非コードRNAには、転移RNA(tRNA)やリボソームRNA(rRNA)などのほか、長さが18~24塩基程度のマイクロRNA(miRNA)、約200塩基以上の長鎖ノンコーディングRNA(lncRNA)がある。これらの一部は、転写や翻訳、エピジェネティクスの制御などを介して、細胞の分化やがん化、個体発生や疾患など生体の多様なプロセスに関与する。
共同研究チーム
理化学研究所 生命医科学研究センター
がんゲノム研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
研修生(研究当時) 江畑 信孝(えばた のぶたか)
(現がんゲノム研究チーム 客員研究員)
北海道大学大学院 医学研究院 外科学分野 消化器外科学教室II
教授 平野 聡(ひらの さとし)
講師 中村 透(なかむら とおる)
原論文情報
- Nobutaka Ebata, Masashi Fujita, Shota Sasagawa, Kazuhiro Maejima, Yuki Okawa, Yutaka Hatanaka, Tomoko Mitsuhashi, Ayako Oosawa-Tatsuguchi, Hiroko Tanaka, Satoru Miyano, Toru Nakamura, Satoshi Hirano, Hidewaki Nakagawa, "Molecular Classification and Tumor Microenvironment Characterization of Gallbladder Cancer by Comprehensive Genomic and Transcriptomic Analysis", Cancers, 10.3390/cancers13040733
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
北海道大学大学院医学研究院 外科学分野 消化器外科学教室II
教授 平野 聡(ひらの さとし)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
北海道大学総務企画部広報課 広報・渉外担当
Email: kouhou [at] jimu.hokudai.ac.jp
※[at]は@に置き換えてください。
