理化学研究所(理研)光量子工学研究センター先端光学素子開発チームの山形豊チームリーダー、青木弘良研究員、バイオリソース研究センター微生物材料開発室の大熊盛也室長、雪真弘開発研究員(研究当時)らの共同研究グループは、微生物の1細胞ゲノム解析[1]用マイクロカプセルを開発しました。
本研究成果は、微生物を対象とする環境科学、バイオテクノロジー、および医療分野などへの貢献が期待できます。
地球上にはさまざまな微生物が存在し、複雑で多様な生態系を形成しています。しかし、ほとんどの微生物は培養が難しく、その機能は不明です。
今回共同研究グループは、微生物1細胞のゲノムDNA[2]解析(1細胞ゲノム解析)用に、微細な「アガロースゲル・マイクロカプセル(AGM)」を開発しました。AGMの内部は液状で、外側はアガロース[3](寒天)で覆われ、安価かつ簡単に作製できます。AGM内に1個の微生物細胞を包埋し、ピコリットル(pL、1pLは1兆分の1リットル)スケールの微小空間での酵素反応により、従来よりも均一にDNAを増幅し、高品質なゲノム情報が得られます。
本研究は、オンライン科学雑誌『Scientific Reports』(10月18日付)に掲載されました。
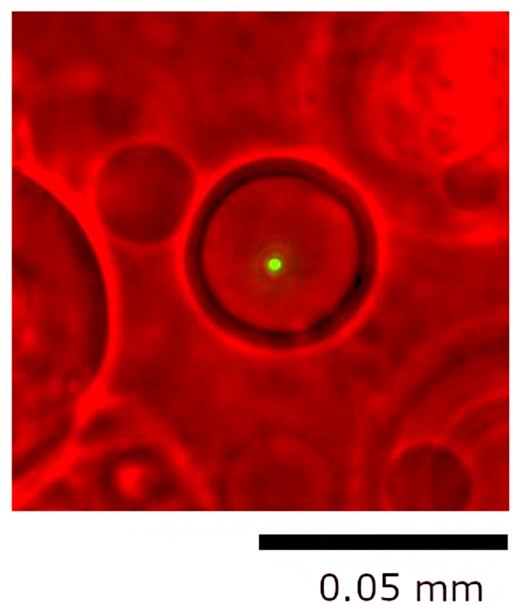
1細胞ゲノム解析用マイクロカプセルの顕微鏡像(緑点は大腸菌)
背景
地球上にはさまざまな微生物が存在し、環境・産業・医療などにおいて重要な役割を担っています。しかし、ほとんどの微生物は培養できず、その生態や機能はベールに包まれています。
そこで近年、微生物群集を培養することなく、環境中のゲノムDNAを精製して微生物群集の機能を解析する「メタゲノム解析[4]」により、多種多様な微生物の姿が徐々に明らかになっています。一方、集団を対象とするメタゲノム解析に対し、1個の微生物細胞を対象とする「1細胞ゲノム解析」では、より高精度なゲノム情報が得られます。
しかし、微量のゲノムDNAを解析に必要な量まで増幅すると、不均一に増幅され(増幅バイアス[5])、全体のゲノム情報が得られにくいという課題がありました。増幅バイアスの抑制には反応量の微量化が有効ですが、専用装置[6]が必要です。そのため、環境微生物の1細胞ゲノム解析には、簡便に作製できる微量反応カプセルが求められていました。
研究手法と成果
共同研究グループは、1細胞ゲノムDNAの簡便で均一な増幅のため、内部は液状、外側はアガロースゲルで覆われた「アガロースゲル・マイクロカプセル(AGM)」を開発しました(図1)。
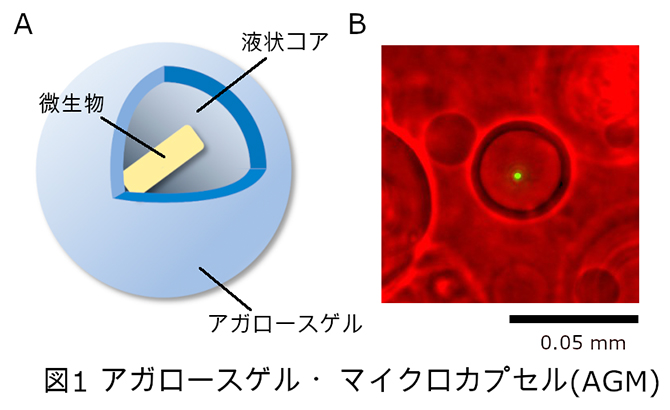
図1 アガロースゲル・マイクロカプセル(AGM)
- AAGMの模式図。解析対象の微生物が含まれた液状コアを、アガロースゲルで覆っている。
- BAGMの顕微鏡像。緑は大腸菌。
AGMは次のように作製します。まず、微生物とアルギン酸[7]の混合物をオイル中に分散させてゲル化させ、中心となるコアを作製します。このコアと加熱して溶かしたアガロースを混和した後、再度オイル中に分散させ、冷却することでアガロースをゲル化させます。これを洗浄後、コアを溶かし、微量反応カプセルとします(図2)。AGMは、安価な試薬と市販の実験器具を用いて、1回の操作で数十万個を作製できます。
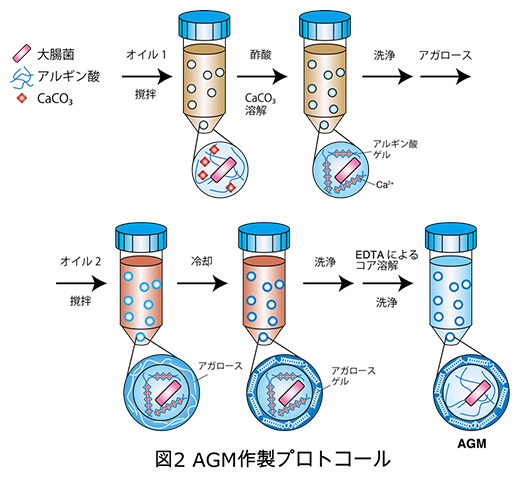
図2 AGM作製手順
最初に、大腸菌、アルギン酸および炭酸カルシウム(CaCO3)の混合物を、50mLプラスチックチューブ内のオイル1(イソステアリルアルコール)に、懸濁して分散させる。次に酢酸でCaCO3を溶解すると、Ca2+とアルギン酸が結合したアルギン酸ゲルコアができる。このコアと加熱して溶かしたアガロースを混和後、オイル2(ポリグリセリル-6オクタカプリレート)に分散させて冷却し、コアの外側にアガロースゲルを形成する。最後に、EDTA(エチレンジアミン四酢酸)でアルギン酸ゲルを溶解後、洗浄し、AGMを作製する。
実際に、AGMを用いて1細胞ゲノム解析を行いました。評価用試料には、大腸菌やヒト腸内細菌混合物(モデルサンプル)、シロアリ腸内細菌を使用しました。シロアリは腸内に無数の微生物が共生しており、協同して効率よく植物バイオマスを分解します。シロアリ腸内細菌は高いセルラーゼ[8](セルロース分解酵素)活性を持ち、産業的にも注目されています。
各微生物試料をAGMに包埋後、従来法の約100万分の1の量に相当するピコリットル(pL、1pLは1兆分の1リットル)スケールで、Phi29 DNAポリメラーゼという酵素でゲノムDNAを増幅しました。ゲノムDNAが増幅されたAGM(図3A)を単離後、次世代DNAシーケンサー[2]で塩基配列を解析し、ゲノムDNAの均一性を評価しました。その結果、いずれの試料においても、AGMを使ってゲノムDNAを増幅した場合、従来法に比べてゲノムDNAのカバー率が高く、均一なゲノムDNAが得られることが明らかになりました(図3B)。これにより、従来の課題を解決し、簡便で高精度な微生物の1細胞ゲノムDNA解析法を確立しました。
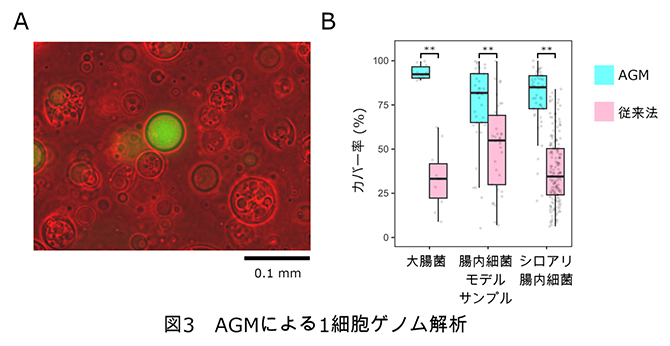
図3 AGMによる1細胞ゲノム解析
- AAGM内で増幅したゲノムDNA。緑が増幅されたDNAを示している。
- BAGMと従来法で、増幅後のゲノムDNAの均一性を比較した。AGMは従来法よりもDNAのカバー率が高く、より均一なゲノムDNAが得られた。**: P<0.01
今後の期待
本研究により、微生物の1細胞ゲノム解析が容易になったことから、これまで解析が困難だった微生物について新たな知見が得られると期待できます。例えば、シロアリの腸内細菌のゲノムをAGMを使って高精度に解析することで、従来のメタゲノム解析では捕捉が困難だった微生物の解析や、微生物間の複雑な相互作用の解明が可能となると考えられます。
また、ヒトの腸内にもさまざまな微生物が存在し、腸内細菌群集のバランスによって私たちの健康が維持されています。これを1細胞ゲノム解析することで、疾患と腸内細菌群集の関係の解明や、腸内細菌の活性化による健康増進、大腸がんの新しい予防医療の確立など、私たちの健康や医療に関連したさまざまな問題解決につながると考えられます。
本手法に用いる試薬は、キットとして製品化することも見込まれます。今後は、ハイスループット解析に向けて、AGM自動作製装置や単離装置を開発し、本手法の普及と高度化を図りたいと考えています。
補足説明
- 1.1細胞ゲノム解析
微細なガラス管や蛍光セルソーターなどの、専用機器を用いて微生物を単離し、ゲノムDNAを解析する方法。メタゲノム解析に比べて工程が多いものの、得られる遺伝情報が1個の微生物細胞に由来するなど、メタゲノム解析にはない利点がある。 - 2.ゲノムDNA、次世代DNAシーケンサー
ゲノムDNAは、生物を形作る設計図となる遺伝物質。遺伝情報は、ACGTの四つの塩基の組み合わせ(配列)で形成される。ゲノムDNA上の塩基配列から、生物の機能を担うタンパク質の設計図である遺伝子配列を同定し、遺伝子の機能から生物の機能を推定する。微生物のゲノムDNAは数100万塩基あり、従来塩基配列の解析は困難であったが、近年次世代DNAシーケンサーの発達により、数日で読み取ることが可能になった。そのため巨大なゲノムDNAを、いかに均一に増幅するかが、課題である。 - 3.アガロース
海藻から得られる寒天をさらに精製し、品質を高めたもの。透明性が高く、さまざまなバイオ実験に用いられる。加熱すると溶解し、冷却するとゲル化する。 - 4.メタゲノム解析
微生物群集を培養することなく、環境試料から微生物ゲノムDNAをそのまま抽出し、網羅的に塩基配列を解析する方法。得られた塩基配列を互いの類似性に基づいて分類して組み合わせ、ゲノムDNA上の塩基配列を再構成する。 - 5.増幅バイアス
1細胞のゲノムDNAは非常に微量のため、酵素を用いて、解析に必要な量まで複製増幅する。その際、高い増幅効率を持つ酵素が用いられるが、局所的なゲノムDNAが指数関数的に増幅され、結果的に増えない箇所の遺伝情報が得られにくいという課題がある。反応量微量化は、過度なゲノムDNA増幅を抑制し、増幅バイアス拡大を防止する。 - 6.専用装置
微小反応量反応チャンバーとして、半導体製造技術(MEMS技術)で作られた微細なウェルとマイクロ流路、およびマイクロ流路によって作製した微小液滴が用いられる。市販装置は少なく、多くの場合自前のMEMS設備で作製する必要がある。 - 7.アルギン酸
海藻から得られる多糖類。カルシウムイオンによってゲル化し、逆にカルシウムイオンと結合するEDTA(エチレンジアミン四酢酸)によって液状化する。 - 8.セルラーゼ
植物繊維であるセルロースを分解する酵素。洗剤などに使用され、工業的に有用である。
共同研究グループ
理化学研究所
光量子工学研究センター先端光学素子開発チーム
チームリーダー山形豊(ヤマガタ・ユタカ)
研究員青木弘良(アオキ・ヒロヨシ)
バイオリソース研究センター微生物材料開発室
室長大熊盛也(オオクマ・モリヤ)
開発研究員(研究当時)雪真弘(ユキ・マサヒロ)
テクニカルスタッフⅠ清水美智留(シミズ・ミチル)
東京工業大学生命理工学院本郷研究室
教授本郷裕一(ホンゴウ・ユウイチ)
研究支援
本研究は、理化学研究所新領域開拓課題「共生の生物学(研究代表者:大野博司)」、同エンジニアリングネットワーク「アガロースゲルマイクロカプセル・プロテオームディスプレイによる、シロアリ腸内細菌からの有用遺伝子の網羅的スクリーニング(研究代表者:青木弘良)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「シロアリ腸内微生物群集の網羅的シングルセル解析による複雑性成立機構の解明(研究代表者:大熊盛也)」、同基盤研究(C)「一菌体ゲノム解析用ハイドロゲル・マイクロカプセルの開発(研究代表者:青木弘良)」、同新学術領域研究(研究領域提案型)「ポストコッホ微生物資源の基盤整備(研究代表者:大熊盛也)」、公益財団法人発酵研究所一般研究助成「難培養微生物の培養を目指した新規共培養法の構築(研究代表者:雪真弘)」による助成を受けて行われました。
原論文情報
- Hiroyoshi Aoki, Masahiro Yuki, Michiru Shimizu, Yuichi Hongoh, Moriya Ohkuma, and Yutaka Yamagata, "Agarose gel microcapsules enable easy-to-prepare, picolitre-scale, single-cell genomics, yielding high-coverage genome sequences", Scientific Reports, 10.1038/s41598-022-20923-z
発表者
理化学研究所
光量子工学研究センター先端光学素子開発チーム
チームリーダー山形豊(ヤマガタ・ユタカ)
研究員青木弘良(アオキ・ヒロヨシ)
バイオリソース研究センター微生物材料開発室
室長大熊盛也(オオクマ・モリヤ)
開発研究員(研究当時)雪真弘(ユキ・マサヒロ)
 山形豊
山形豊
 青木弘良
青木弘良
 大熊盛也
大熊盛也
 本郷裕一
本郷裕一
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
